|
درباره وبلاگ به وبلاگ من خوش آمدید آرشيو وبلاگ
علوم
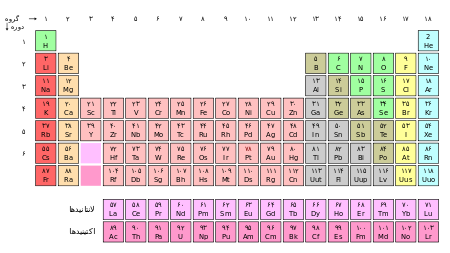
جدول تناوبی عنصرهای شیمیایی، نمایشی از عنصرهای شیمیایی شناخته شدهاست که بر اساس مرتب گردیدهاست بهگونهای که بسیاری از عنصرها به صورت منظم در طول جدول تغییر میکنند. جدول اولیه بدون اطلاع از ساختار داخلی اتمها ساخته شد: اگر عناصر را بر حسب جرم اتمی آنها مرتب نمائیم، و آنگاه نمودار خواص معین دیگر آنها را بر حسب جرم اتمی رسم نمائیم، میتوان نوسان یا تناوب این خواص را بصورت تابعی از جرم اتمی مشاهده نمود. نخستین کسی که توانست این نظم را مشاهده نماید، یک شیمیدان آلمانی به نام بود. او متوجه تعدادی تثلیث از عناصر مشابه شد:
و به دنبال او، شیمیدان انگلیسی متوجه گردید که عناصر از نوع مشابه در فاصلههای هشت تایی یافت میشوند، که آنها را با نتهای هشتگانه موسیقی شبیه نمود، هرچند که قانون نتهای او مورد تمسخر معاصرین او قرار گرفت. سرانجام شیمیدان آلمانی و شیمیدان روسی دمیتری مندلیف تقریباً بطور همزمان اولین جدول تناوبی را، با مرتب نمودن عناصر بر حسب جرمشان، توسعه دادند (ولی مندلیف تعداد کمی از عناصر را خارج از ترتیب صریح جرمی، برای تطابق بهتر با خواص همسایگانشان رسم نمود – این کار بعدها با کشف ساختار الکترونی عناصر در اواخر صده نوزدهم و آغاز صده بیستم توجیه گردید). فهرست عناصر بر پایه نام، علامت اختصاری و عدد اتمی موجود است. شکل زیر جدول تناوبی عناصر شناخته شده را نمایش میدهد. هر عنصر با عدد اتمی و علامتهای شیمیایی. عناصر در یک ستون («گروه») از لحاظ شیمیایی مشابه میباشند. کد رنگ برای اعداد اتمی:
و میتوانید دراین کلید واژه جدول تناوبی برای را بیابید.
از آنجائیکه الکترونهای خارجیترین لایه، خواص شیمیایی را تعیین مینمایند، این لایهها در میان گروهای یکسان مشابهاند.عناصر همجوار با یکدیگر در یک گروه، علیرغم اختلاف مهم در جرم، دارای خواص فیزیکی مشابه هستند. عناصر همجوار با یکدیگر در یک ردیف دارای جرمهای مشابه ولی خواص متفاوت هستند. برای مثال، عناصر بسیار نزدیک به نیتروژن (N) در ردیف دوم کربن(C) و اکسیژن(O) هستند. علیرغم تشابه آنها در جرم (که بصورت ناچیزی در تفاوت دارند)، دارای خواص بینهایت متفاوتی هستند، همانطور که با بررسی فرمهای دیگر میتوان ملاحظه نمود: اکسیژن دو اتمی یک جامد است که میتواند سوزانده شود(بله، میتوان الماس را سوزاند!). در مقایسه، عناصر بسیار نزدیک به کلر (Cl) در گروه یکی مانده به آخر در جدول (هالوژنها) فلوئور(F) و برم(Br) هستند. علیرغم تفاوت فاحش جرم آنها در گروه، فرمهای دیگر آنها دارای خواص بسیار مشابه هستند: آنها بسیار فلزات، برای تشکیل نمک )؛ کلر و فلوئور گاز هستند، درحالیکه برم یک مایع با تبخیر بسیار کم است؛ کلر و برم بسیار رنگی هستند. جستارهای وابسته
نظرات شما عزیزان:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
نویسندگان
پیوندها
آخرین مطالب
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 آمار
وب سایت:
آمار
وب سایت: